Tính chất hóa học của axit là gì ✅ Chi Tiết
Thủ Thuật về Tính chất hóa học của axit là gì Chi Tiết
Họ tên bố(mẹ) đang tìm kiếm từ khóa Tính chất hóa học của axit là gì được Update vào lúc : 2022-08-20 05:25:05 . Với phương châm chia sẻ Kinh Nghiệm về trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi Read tài liệu vẫn ko hiểu thì hoàn toàn có thể lại Comments ở cuối bài để Tác giả lý giải và hướng dẫn lại nha.trang chủ » Hóa Học » Tính chất Hóa Học, Vật lý Của AXIT và Cách xác định độ mạnh yếu của Axit
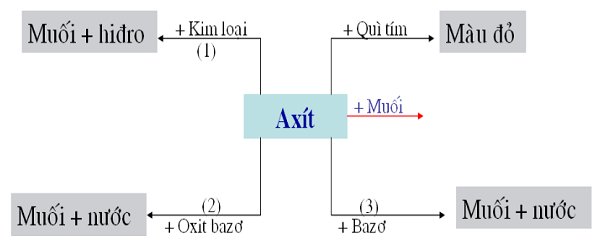
Nội dung chính- Tính Chất Vật Lý Của AXIT Tính Chất Hóa Học Của AXIT 1. Làm đổi màu chất thông tư (quỳ tím, giấy thông tư pH, dung dịch phenol phtalein). 2. Tác dụng được với một số trong những sắt kẽm kim loại tạo thành muối và giải phóng hidro. 3. Tác dụng với bazo tạo thành muối và nước 4. Tác dụng với oxit bazơ tạo thành muối + nước 5. Tác dụng với muối tạo muối mới và axit mới Xác định độ mạnh yếu của axit

Tính chất của axit và cách xác định độ mạnh yếu của Axit sẽ có ngay trong nội dung bài viết này của chúng tôi. Hãy theo dõi nội dung bài viết này để không bỏ lỡ những nội dung mê hoặc và có ích nhất nhé !
Tham khảo nội dung bài viết khác:
- Công thức tính hiệu suất phản ứng là gì ?Axit là gì ? Phân loại những Axit ?
Tính Chất Vật Lý Của AXIT
- Tính chất
vật lý của axitTan trong nước, có vị chua.Khi tiếp xúc với axit mạnh, có cảm hứng đau nhói.Là chất điện li nên hoàn toàn có thể dẫn điện.
Tính Chất Hóa Học Của AXIT
1. Làm đổi màu chất thông tư (quỳ tím, giấy thông tư pH, dung dịch phenol phtalein).

2. Tác dụng được với một số trong những sắt kẽm kim loại tạo thành muối và giải phóng hidro.
Đối với axit sulfuric và axit nitric đặc nóng hoàn toàn có thể tác dụng với hầu hết những sắt kẽm kim loại, tạo khí lưu huỳnh dioxit SO2 (H2SO4) hoặc nito dioxit NO2 (HNO3)
HCl + Fe -> FeCl2 + H2
2Fe + 6H2SO4 -> Fe2(SO4)3 + 6H2O + 3SO2
3. Tác dụng với bazo tạo thành muối và nước
Cu(OH)2 + H2SO4 -> CuSO4 + 2H2O
4. Tác dụng với oxit bazơ tạo thành muối + nước
Na2O + 2HCl → 2NaCl + H2
FeO + H2SO4(loãng) → FeSO4 + H2O
CuO + 2HCl → CuCl2 + H2O
5. Tác dụng với muối tạo muối mới và axit mới
Điều kiện xảy ra phản ứng
- Muối phản ứng là muối tan.Muối mới không tan trong axit mới.Sản phẩm có chứa một chất kết tủa hoặc bay hơi.
H2SO4 + BaCl2 → BaSO4(r) + 2HCl
K2CO3 + 2HCl → 2KCl + H2O + CO2 (axit cacbonic phân hủy ra nước và khí cacbonic)
Xác định độ mạnh yếu của axit
==> Độ mạnh, yếu của những axit được xác định nhờ vào sự linh động của nguyên tử Hydro trong axit đó, nếu nguyên tử Hydro càng linh động thì tính axit càng mạnh và ngược lại.
1. Với những axit có oxy trong cùng một nguyên tố, càng ít oxy, axit càng yếu
HClO4 > HClO3> HClO2> HClO
2. Với những axit của nguyên tố trong cùng chu kỳ luân hồi, khi những nguyên tố ở hóa trị cao nhất, nguyên tố trung tâm có tính phi kim càng yếu thì axit đó càng yếu.
HClO4> H2SO4> H3PO4
3. Với axit của nguyên tố cùng nhóm A
+) Axit có oxy: Tính axit tăng dần từ dưới lên: HIO4 < HbrO4< HClO4
+) Axit không còn oxy: Tính axit giảm dần từ dưới lên: HI > HBr> HCl> HF
4. Với axit hữu cơ RCOOH
Nếu R đẩy electron (gốc R no) thì tính axit giảm
HCOOH> CH3COOH> CH3CH2COOH> CH3CH2CH2COOH> n-C4H9COOH.
Nếu R hút e (gốc R không no, thơm hoặc có nguyên tố halogen,…), tính axit sẽ mạnh
Cám ơn bạn đã theo dõi nội dung bài viết này của chúng tôi, cùng theo dõi những nội dung bài viết khác trên trang web của chúng tôi để không bỏ lỡ những thông tin hay và hữu ích khác nhé !
Tải thêm tài liệu liên quan đến nội dung bài viết Tính chất hóa học của axit là gì